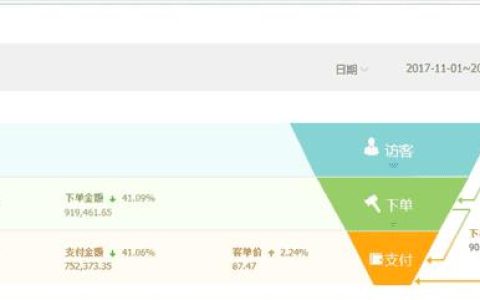
溶液中离子浓度大小比较
一.基本理论依据
电离过程是微弱的,发生电离的微粒的浓度大于电离生成微粒的浓度
水解过程是微弱的,发生水解的微粒的浓度大于水解生成微粒的浓度
二.溶液中粒子浓度大小比较的主要类型
多元弱酸溶液
多元弱酸分步电离,逐级减弱,比如说在磷酸(H3PO4)溶液中各种离子浓度的大小关系,如下图:

2.多元弱酸的正盐溶液
根据弱酸酸根离子的分步水解分析,水解程度逐级减弱。比如说在碳酸钠(Na2CO3)溶液中各种离子浓度的大小关系,如下图:

这里需要指出氢氧根离子浓度大于碳酸根离子浓度,碳酸根水解产生的碳酸氢根离子和氢氧根离子开始相等,但接下来碳酸氢根离子继续水解,使得氢氧根离子浓度大于碳酸氢根离子浓度。
3.不同溶液中同一离子浓度的比较
根据溶液中其他离子对该离子产生的影响来比较。比如,在相同物质的量浓度的下列溶液中,比较铵根离子(NH4+)浓度的大小:硝酸铵溶液(NH4NO3),醋酸铵溶液(CH3COONH4),硫酸氢氨溶液(NH4HSO4),比较过程如下图:

4.混合溶液中各离子浓度的比较
这个要进行综合分析,如电离因素,水解因素等。如,在0.1摩尔每升的氯化铵(NH4CL)和0.1摩尔每升的氨水(NH3.H2O)混合溶液中,各离子浓度大小关系,如下图:

解析完毕。
学生对这些知识总是容易混淆,掌握不了,专门整理出来,方便学生记忆,使用。希望更多的同学能用上,大家觉得有问题的地方,请及时评论指出,觉得不错的,也请评论,点赞,转发,收藏,留下您的足迹。您的评论是对我最大的支持。

本文内容源自网友投稿,多成号仅提供信息存储服务不拥有所有权。如有侵权,请联系站长删除。qq97伍4伍0叁11